
北京COOL青年:一根针冻死肿瘤?这项技术你需要知道!
2024-01-12 阅读次数:948次
近年来,重大疾病的诊断和治疗技术取得了极大的进步,然而恶性肿瘤治疗依然面临重大挑战。大多数肿瘤患者在确诊时已处于中晚期,失去了手术彻底切除的机会,对于高龄、身体虚弱或器官功能储备不足的肿瘤患者,更是无法承担手术风险。肿瘤物理消融技术的快速发展为更多肿瘤患者带来新的希望,特别是冷冻消融以其独特的治疗效果和相对更高的安全性被许多肿瘤患者认可,在临床中发挥着重要作用。
一、什么是冷冻消融
冷冻消融,顾名思义即通过冷冻破坏组织的方法。冷冻疗法是人类最早尝试的肿瘤治疗方法之一。写于公元前2500年至2000年的《艾德温·史密斯纸草文稿》(Edwin Smith Papyrus)记载了人们使用冷敷处理乳房的伤口或脓肿。“西方医学之父”希波克拉底也意识到了低温的消肿镇痛作用,将其用于处理伤口上。

图1 《艾德温·史密斯纸草文稿》
图片来源于网络
19世纪中叶,James Arnott博士将含有碎冰的盐溶液冷冻乳腺癌、宫颈癌和皮肤癌,不仅疼痛得到改善,肿瘤也发生缩小或消退。1961年,神经外科医生Irving Cooper博士和同事开发了基于液氮冷却组织的冷冻手术系统,成为现代冷冻消融系统雏形。
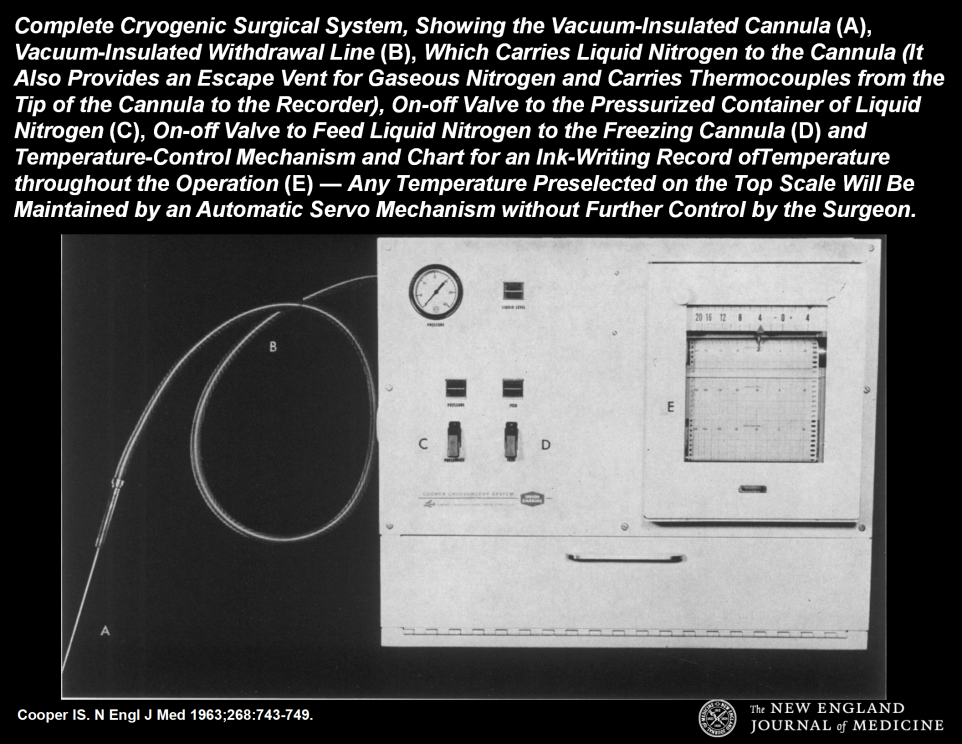
图2 Irving Cooper博士开发的低温手术系统
图片来源于Irving Cooper
经过数十年的技术改进,早期直视下单纯冷冻疗法已发展为集成低温与高温消融的新型复合式冷冻消融技术,治疗路径包括影像引导下经皮穿刺、经支气管镜、腹腔镜和开腹手术,其中经皮穿刺创伤小、花费低、可重复,因此临床应用最多。操作程序简单来说,由手术医师在CT或超声等影像设备引导下,将冷冻探针穿刺进入病灶,探针尖端的病灶组织冷却至-196℃,局部形成“冰球”,随后逐渐复温至80℃左右再次消融提高杀灭肿瘤效率。在实际操作中可重复多次“降温-升温”循环以提高消融效果,也避免了传统单纯冷冻消融后的出血问题。
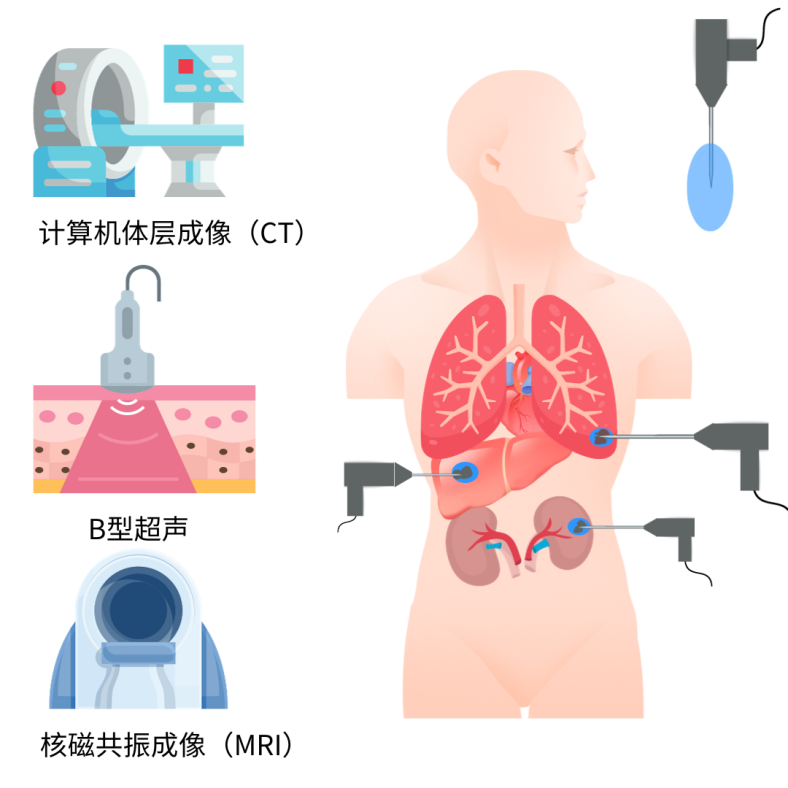
图3 影像引导下的微创冷冻消融术
图片来源于徐婕
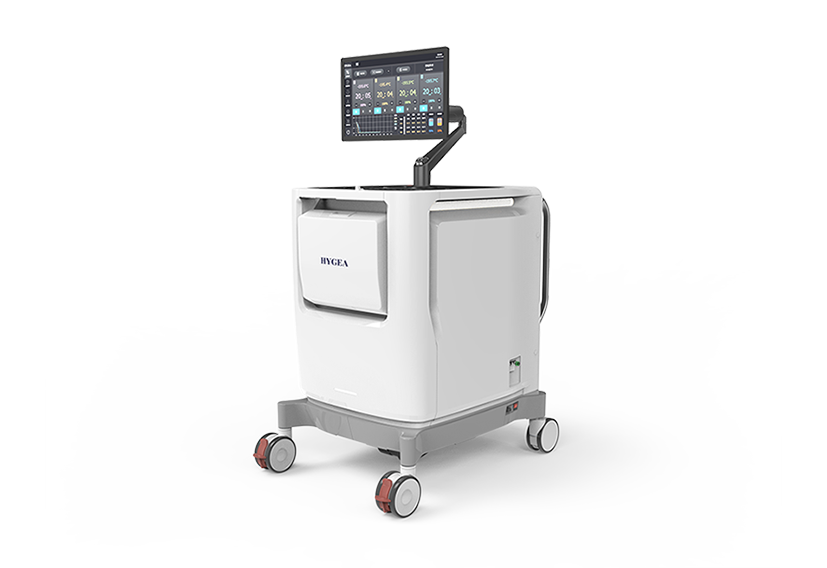
图4 复合式冷热消融系统(海杰亚康博刀®)
图片来源于网络
二、冷冻消融作用机制
冷冻消融的作用机制包括直接细胞损伤、血管损伤和诱导免疫反应。
01
随着病变组织温度降低,细胞外冰晶形成,导致胞外渗透压升高,细胞脱水皱缩;细胞内冰晶形成破坏细胞器和质膜,损害细胞功能。在升温过程中,细胞内重结晶加剧机械损伤,胞外渗透压骤然降低,细胞肿胀破裂死亡。
02
低温使肿瘤局部微血管收缩,冰晶形成也损伤了肿瘤微血管内皮细胞;升温过程中,微血管扩张发生再灌注使血小板接触受损血管内皮,形成血栓,导致肿瘤组织缺血缺氧,炎性因子释放,在多重环境压力下肿瘤组织发生凝固性坏死。
03
冷冻消融后坏死细胞与细胞因子募集巨噬细胞、中性粒细胞,激发先天性免疫反应;原位坏死的肿瘤细胞释放内容物作为抗原物质,经树突状细胞提呈抗原诱导全身免疫反应,开始攻击全身肿瘤细胞,可能导致消融病灶远处未经治疗的肿瘤出现自发地缩小或消退。
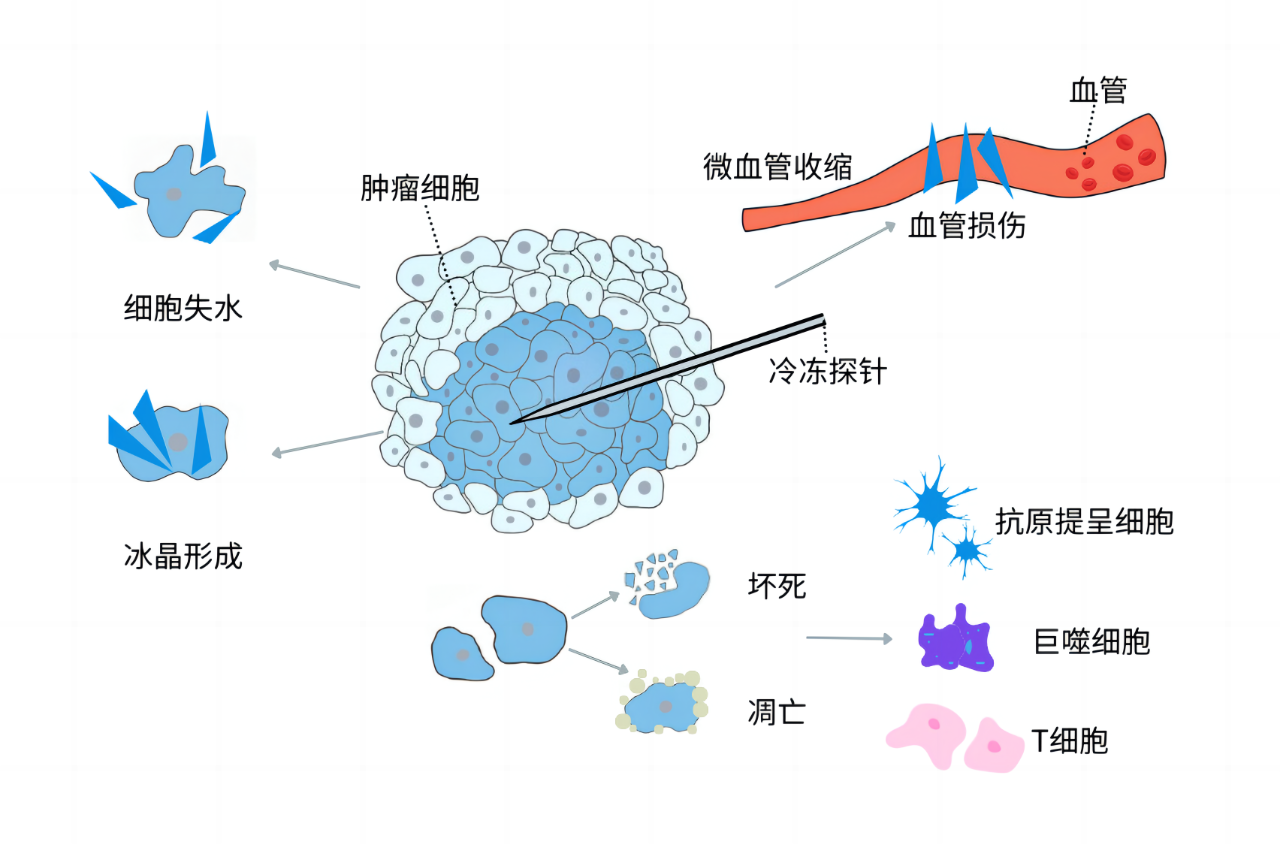
图5 冷冻消融作用机制
图片来源于徐婕
三、冷冻消融的优势
01
冷冻消融的作用机制为物理损伤,不像射频消融依赖闭环电路,因此不会对影像学设备产生干扰,也适用于安装心脏起搏器的肿瘤患者。术中患者只需要进行局部麻醉,即可在意识清醒的情况下接受手术。冷冻探针直径仅有一两毫米,手术伤口极小,术后仅用创可贴那样的一块外敷料贴好就可回病房,并发症较少,恢复时间短,节约了许多治疗成本。

图6 冷冻探针
图片来源于网络
02
冷冻消融对局部肿瘤组织进行精准可控的物理性破坏。手术医师在术中不仅可以通过CT扫描图像清晰地看到消融边界的动态变化,而且可以操作多个冷冻探针来布局设计,或调整冷冻参数、输出功率来扩大消融范围,雕刻冰球形状,既保护了肿瘤周围的正常组织和重要器官,又贴合了肿瘤本身不规则的形态,提高手术的精准度。
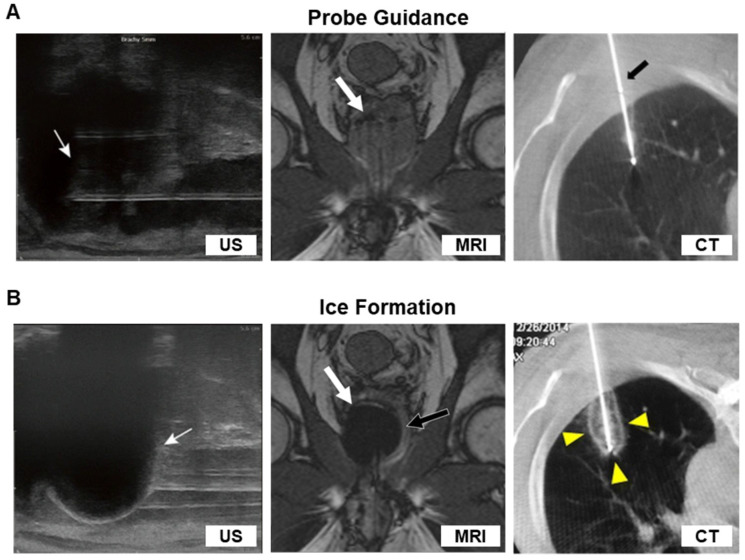
图7 超声、MRI、CT显示的术中成像
图片来源于Kijung Kwak
03
对于癌性疼痛患者,冷冻消融不仅能够减少肿瘤压迫带来的不适,同时低温阻断局部神经通路,破坏痛觉传导,起到良好的镇痛作用。
04
如前所述,冷冻消融能有效诱导全身先天性和适应性免疫反应,同时增强了肿瘤细胞对免疫检查点抑制剂的敏感性,放大免疫治疗效果。因此,许多临床研究正在探索冷冻消融联合免疫疗法的有效性和安全性,有望为更多的患者带来获益。
四、冷冻消融在恶性肿瘤治疗中的应用
大部分实体非空腔脏器的良、恶性肿瘤及转移瘤均可进行冷冻消融治疗,尤其适用于传统抗肿瘤治疗效果欠佳,或因肿瘤解剖局部情况、高龄、基础疾病等原因不适宜外科手术,或个人意愿不愿意接受外科手术的患者,如肺癌、肝癌、肾癌、骨或软组织肿瘤等。冷冻消融与化疗、靶向治疗以及中医药治疗等局部+全身的联合治疗策略已经显示出令人满意的临床疗效,必将极大推动肿瘤治疗领域的进步。
1、肺癌
对于高危肺结节及肺早癌、以控制为治疗目的的中晚期非小细胞肺癌和小细胞肺癌、术后复发或第二原发性肺癌,以及其他部位恶性肿瘤发生的肺转移癌等情况,微创冷冻消融是有效的治疗手段。
2、肝癌
对于直径≤3cm的肝细胞癌,局部消融治疗与外科手术疗效相当,为不耐受或拒绝手术切除的患者提供了治疗机会。若单发病灶手术后切缘残留或复发,也可通过冷冻消融进一步治疗。冷冻消融也适用于转移性肝癌病灶超过3个无法外科切除且原发病灶得到有效控制的患者,对于晚期原发性肝癌,可采用冷冻消融治疗联合动脉栓塞化疗术,尽可能减轻肿瘤负荷、缓解临床症状。术后并发症包括感染、出血、肋间神经损伤等,因此需要进行充分术前准备和准确定位,术中密切动态监测以减少并发症发生率。
3、肾癌
肾癌外科治疗一般采取肾脏全切除术或保留肾单元的肾脏切除术,损伤大、术后恢复慢,精准定位的局部消融技术显得十分重要。当肾癌病灶多发,或肿瘤最大径<5cm可进行冷冻消融治疗,对于肿瘤体积巨大、累及肾门等重要结构的情况,冷冻消融可以极大减轻肿瘤负荷,为其他治疗争取机会。由于肾组织血供丰富,术后可能出现出血、局部感染,可应用止血药物并积极抗感染治疗。
4、胰腺癌
对于胰腺癌局部病变≤3cm,且未扩散至周围组织或远处器官的早期患者,冷冻消融是一种有效的替代治疗方案。有研究显示无法进行手术的晚期患者,冷冻消融联合放射性粒子植入是姑息性治疗的选择之一,可以有效缓解症状,控制肿瘤进展。
5、骨与软组织肿瘤
骨与软组织肿瘤包括原发或继发性骨肿瘤,肉瘤及神经源性肿瘤等,治疗方法以手术切除为主,但难以得到根治,且易造成残疾。冷冻消融同时配合全身治疗的方法不仅能有效控制肿瘤进展,也避免了手术带来的二次伤害。CT引导下冷冻消融适用于恶性骨与软组织肿瘤已发生转移,或放化疗等传统治疗方法疗效欠佳,或无法耐受手术的局限性原发或继发骨与软组织肿瘤患者。对于转移性骨肿瘤疼痛明显的患者,术后症状会明显减轻。长骨骨肿瘤在治疗后4~8周可能会发生病理性骨折,可在消融完成后注射骨水泥增强骨质持重力。
参考文献
撰稿:徐婕 北京中医药大学硕士研究生
审核:周天 北京制冷学会理事、北京中医药大学东方医院肿瘤科副主任/副主任医师
编辑:王晓童